Субмукозные узлы при климаксе
Содержание статьи
Миома матки в постменопаузе
.
Для миомы матки в постменопаузе характерны некоторые особенности морфологического строения, свидетельствующие об их меньшей пролиферативной активности по сравнению с миомой матки у женщин более молодого возраста. Это выражается в гипотрофии мышечных клеток, разрастании соединительной ткани и возрастании количества дистрофических изменений. В постменопаузе узлы миомы, возникшие еще в пременопаузе, так же, как и матка, подвергаются инволюции — уменьшается их диаметр, причем узлы, имевшие повышенную эхоплотность (фибромиома), претерпевают наименьшие изменения, а узлы средней или повышенной эхогенности (лейомиома) уменьшаются наиболее заметно. Наряду с этим повышается эхоплотность, особенно капсулы миоматозных узлов, что может приводить к ослаблению эхосигнала и затруднять визуализацию внутренней структуры миоматозных узлов. Редко встречается кистозная дегенерация узла миомы (субсерозная локализация) с множеством полостей и гипоэхогенным содержимым. При исследовании кровотока в миоматозных узлах после атрофии, интранодулярная регистрация цветовых эхосигналов нехарактерна, перинодулярный кровоток скудный. При интерстициальных узлах атрофические процессы в матке в постменопаузе могут приводить к усилению центрипетальных тенденций и появлению субмукозного компонента миоматозного узла. Субмукозное расположение миоматозных узлов в постменопаузе может способствовать появлению кровотечения.
В период постменопаузы показатели уровня экспрессии рецепторов к половым стероидным гормонам в клетках миомы достоверно ниже, чем в других возрастных группах, что связывают с развитием инволютивных процессов в половой системе женщин. Регресс миомы матки в постменопаузе обусловлен повышением уровня апоптоза при снижении пролиферативной активности, что проявляется достоверным снижением значений белка Bel-2 в тканях по отношению к данным больных с нерегрессирующей миомой матки и здоровых женщин в постменопаузе.
Определение экспрессии ароматазы в клетках миомы является важным с точки зрения выявления патогенеза опухолей и потенциальных направлений терапии. Заметно возрастает число исследований, которые предполагают, что у женщин в постменопаузе эстрогены, локализованные в опухолевых клетках, происходят из ароматизации in situ в патологически нарушенной ткани и что они действуют локально как митогенный фактор, способствующий росту опухоли независимо от концентрации эстрогенов в сыворотке крови.
У женщин в постменопаузе циркулирующие эстрогены происходят главным образом из периферической конверсии андрогенов. Такая конверсия имеет место в основном в периферических тканях, но, как подтверждено результатами исследований экспрессии гена ароматазы, локальный синтез андрогенов в карциноме эндометрия проявляется также, если количество продуцируемых гормонов недостаточно для увеличения пула эстрогенов в периферической крови. В эксперименте доказано, что клетки миомы способны синтезировать достаточное количество эстрогенов для поддержания собственного роста.
Увеличение матки и/или миоматозных узлов в постменопаузе, если оно не стимулировано МГТ, всегда требует исключения гормонпродуцирующей опухоли яичников или саркомы матки. Рост миомы в постменопаузе является показанием к хирургическому лечению — гистерэктомии.
Макроскопические характеристики миомы матки, лечение которой хирургическое, в возрасте постменопаузы различаются преимущественно единичными, но небольшими по морфометрическим параметрам опухолевыми узлами. В постменопаузальном периоде миома матки, требующая хирургического лечения, сочетается у каждой третьей пациентки с хроническим эндометритом, гиперпластическими процессами эндометрия, аденомиозом. Таким образом, у пациенток постменопаузального возрастного периода имеет место сочетание нескольких триггерных факторов, дополняющих друг друга, которые приводят к необходимости оперативного вмешательства при миоме матки: метаболические нарушения (ожирение), хронические заболевания печени, гиперплазия тека-ткани и кистомы яичников в сочетании с хроническим воспалением матки и придатков, аденомиозом и гиперпластическими процессами эндометрия.
Эхографически при субмукозной форме миомы матки диагноз основывается на визуализации округлого или овоидного образования среднего уровня звукопроводимости (близко к миометрию) в проекции полости матки. Однако в постменопаузе нередко невозможно определить соотношение интерстициального и субмукозного компонентов, поскольку М-эхо тонкое, сливается с капсулой узла и не позволяет четко определить границы полости матки. Диагностические трудности можно решить с помощью гидросонографии и гистероскопии. Гидросонография благодаря контрастированию полости матки дает возможность четко определить не только локализацию узла, соотношение интерстициального и субмукозного компонентов, но и состояние эндометрия.
При единичной субмукозной миоме матки небольших размеров в постменопаузе показана миомэктомия трансцервикальным доступом (гистерорезектоскопия) при наличии условий для проведения операции. Интерстициально-подслизистые узлы миомы в постменопаузе не являются показанием к хирургическому лечению при отсутствии патологических изменений эндометрия и яичников.
Существуют данные о применении в постменопаузе СМЭР — ралоксифена -синтетического нестероидного препарата. Исследования подтвердили, что ралоксифен значительно уменьшает размеры миомы у женщин в постменопаузе. Кроме того, у женщин, получающих аГн-РГ, ралоксифен значительно уменьшает размеры лейомиомы и этот эффект поддерживается в течение 2 лет после окончания лечения [Palomba S. et al., 2005].
Влияние менопаузальной гормональной терапии (МГТ). Очевидно, что фибромиома после менопаузы должна регрессировать, но МГТ может остановить этот процесс и даже стимулировать рост узлов. При этом добавление прогестагенного компонента не уменьшает этот риск. Несколько различных клинических исследований свидетельствовали о росте фибромиомы на фоне трансдермального применения эстрогенного в сочетании с прогестагенным компонентом МГТ. Точно также инъекционные формы эстрогенов в сочетании с прогестагенами способствовали увеличению размеров и числа узлов миомы. Кроме того, в ряде работ было установлено, что назначение пероральной МГТ не вызывало значимого изменения размеров опухоли. В некоторых исследованиях по изучению влияния пероральной МГТ на миоматозные узлы не было представлено репрезентативной группы сравнения (женщины постменопаузального возраста, которые бы не получали МГТ). Однако в двух работах, которые включали такие группы сравнения, объем миомы незначительно уменьшился у женщин, не получавших МГТ в течение длительного времени. И только в двух исследованиях с включением контрольных групп высказано предположение, что назначение пероральной МГТ может замедлять нормальный менопаузальный регресс миомы матки.
Влияние МГТ на рост узлов миомы матки у женщин после менопаузы — сложная проблема, разрешимая только на основании дальнейших исследований. Яркой иллюстрацией этого является утверждение Polatti и соавт. (2000) о том, что увеличение объема или числа фибромиом матки во время приема МГТ в постменопаузе, вероятно, не связано исключительно с дозой и путем введения эстрогенного компонента, а возможно зависит от дозы и типа применяемого прогестагенового компонента. Для постменопаузы характерно снижение лигандопосредованного апоптоза, что установлено при исследовании соотношения циркулирующих Fas/FasL у женщин в постменопаузе, получающих МГТ. Половые стероидные гормоны оказывают влияние на рост лейомиомы, стимулируя клеточную пролиферацию в большей степени, чем механизмы апоптоза. Частота клеточной пролиферации ниже в постменопаузе, чем в репродуктивном возрасте, кроме того, она усиливается под действием прогестерона.
Однако миома матки — не противопоказание для МГТ. Препараты МГТ у больных миомой матки можно назначать, если у женщины имеется не более 2-3 узлов не более 3 см. Исключение — субмукозное расположение узла. При этом необходимо динамическое ультразвуковое исследование органов малого таза с доплеромерией 1 раз в 6 мес. При появлении интенсивного кровотока в узлах лечение должно быть отменено и врач решает вопрос о тактике дальнейшего ведения. На практике, большинство женщин с узлами небольших размеров или после оперативного лечения (гистерэктомия или надвлагалищная ампутация матки как с придатками, так и без) могут получать МГТ по показаниям, длительно без какого-либо увеличения миомы матки.
Как альтернатива, в ряде случает для лечения климактерического синдрома у женщин с миомой матки в постменопаузе возможно применение фитоэстрогенов (соевые изофлавоны), которые не приводят к увеличению размеров миоматозных узлов.
Источник
Субмукозная миома: причины, диагностика и лечение
Консультирует акушер-гинеколог, репродуктолог, гинеколог-эндокринолог, врач высшей категории МЦ «Боголюбы» Евгения Щепко.
Что такое субмукозные узлы и как часто их диагностируют?
Субмукозные узлы (миомы) — это доброкачественные образования, которые локализуются в подслизистом слое и частично выступают в полость матки. Есть 4 типа субмукозных миом: нулевой — когда миома на ножке и только в слизистом слое, как правило, небольшая; первый тип — миома частично размещена в подслизистом и мышечном слое; второй тип — большая часть миомы в мышечном слое; третий тип — когда отсутствует мышечная ткань между узлом и слизистым слоем.
Субмукозные миомы составляют 12-25% от всех гинекологических заболеваний, то есть практически каждая четвертая женщина, которая пришла в гинекологическое отделение с жалобами, имеет субмукозные миомы. Кстати, 20-30% субмукозных миом диагностируют в молодом возрасте.
Почему в организме образуются субмукозные миомы?
Причиной образования субмукозных узлов является прежде всего гормональные нарушения, а именно повышение уровня эстрадиола. Как правило, образование и рост всех опухолей сопровождает эстрадиоловий подъем, то есть повышение уровня и избыток эстрогенов.
Что касается эстрогенов, то их депо содержится в жировой ткани. Поэтому любой резкий набор лишнего веса может спровоцировать развитие опухолевых процессов.
Третья причина развития субмукозных узлов — это воспалительные заболевания: неправильно, нерационально, вовремя не пролеченное или не долеченное.
Причиной также могут быть любые механические повреждения эндометрия (аборты, выскабливания и т.д.).
Важную роль играет генетическая предрасположенность, хронические стрессы, отсутствие беременности в 30 лет и грудного вскармливания.
Способствовать образованию субмукозных узлов может прием неправильно предназначенных оральных контрацептивов или их неправильное применение. Большинство населения полагает, что основная задача контрацептивов — не допустить беременность. Но на самом деле контрацептивы имеют также дополнительную, лечебное действие, поэтому их ни в коем нельзя принимать без назначения врача.
Еще один фактор, который повышает риск, — гипертония: она может провоцировать образование субмукозных узлов.
Еще один провокатор — щитовидная железа. Она играет большую роль в регуляции менструального цикла. Поэтому если есть заболевания щитовидной железы, гормональные нарушения, любые аутоиммунные процессы — все это может спровоцировать образование субмукозных миом.
Какие симптомы могут свидетельствовать о наличии субмукозных узлов?
Первым звоночком является нарушение менструального цикла, например, кровянистые выделения до, после или внутри менструального цикла, обильная менструация, а также обильное менструация, которая заканчивается кровотечением, укорочение менструального цикла.
Вследствие увеличения выделений во время менструации снижается уровень гемоглобина, развивается анемия, поэтому появляются сопутствующие симптомы: общая слабость, головокружение, бледность кожных покровов.
К симптомам также относят боль внизу живота, боль во время полового акта, вздутие или увеличение живота, нарушение мочеиспускания и стула. Следствием субмукозной миомы может быть бесплодие. На поздних стадиях — резкий подъем температуры тела, резкие боли внизу живота.
Как диагностируют субмукозные миомы?
При осмотре на гинекологическом кресле, при условии, что узел уже большой, врач может заметить изменения размера матки. Если узел маленький и не дает явных симптомов, метод диагностики, который позволяет его обнаружить, — это УЗИ, трансвагинальное или трансабдоминальное, КТ и МРТ.
Как лечить миому матки?
В зависимости от вида субмукоиновой миомы, места ее расположения, размера, на какой ножке она размещена (тонкой или толстой, количества сосудов в ней и т.д.) и других факторов врачи решают, как удалять узел.
Удаление может происходить гистероскопически, когда специальным прибором (гистероскопом), который оснащен видеокамерой, проникают через влагалище и шейку в полость матки и забирают узел, уничтожая сосудистую ножку, которая его питала, и ложе, где он рос. Гистероскопически удаляется большинство субмукозных узлов.
Второй метод — лапароскопия, предусматривает проникновение в полость матки через живот. К этому методу прибегают, когда узлы большие или их расположение не позволяет их удалить гистероскопически.
Стоит отметить, что для выздоровления механического удаления субмукозного узла недостаточно. Это только начало лечения! Надо устранить факторы, которые привели к его образованию. А именно: скорректировать гормональный фон, стабилизировать состояние женщины. Иначе заболевания появится снова. После удаления субмукозных узлов гормональная терапия продолжается еще минимум три месяца. В большинстве случаев женщинам с лечебной целью назначают контрацептивы, а их назначают минимум на три-шесть месяцев.
Есть способы избавиться субмукозных узлов без операции?
Да, есть консервативное лечение, в частности, гормональная терапия. При очень малых размерах и абсолютном отсутствии симптомов, если в ближайшее время женщина не планирует беременность или по определенным причинам она хочет отложить операцию, в таком случае назначают гормональную терапию. Она притормаживает рост узла на определенный период времени.
Еще один способ лечения — эмболизация маточных артерий. Это перекрытие маточных артерий путем введения вещества, которое склеивает основные сосуды матки. В результате миоме не хватает питания, поэтому она прекращает расти, а со временем мумифицируется. Следует заметить, что к эмболизации прибегают только в случае малого размера миомы.
Если узел большой, и он перестает питаться, начинается некроз, то есть узел начинает отмирать и гнить внутри матки. Это вызывает резкие боли, повышение температуры и представляет риск для жизни пациента. В таком случае надо быстро реагировать и удалять узел.
Еще одна критическая ситуация — срыв узла с ножки. При этом женщина испытывает схваткообразные боли, ведь раскрывается шейка матки и женщина фактически рождает узел. Это называется рождением субмукозного узла. Худшим осложнением этого состояния может быть кровотечение, так как узел отрывается с ножки, которая имеет сосуды.
Можно ли забеременеть при наличии субмукозных узлов?
Нет, это невозможно. Дело в том, что субмукозные узлы размещаются там, где развивается и беременность. Кроме того, узел питается не только кровью, но и гормонами. И даже если каким-то чудом наступит беременность, узел будет постоянно обворовывать эмбрион, ему не хватит кровоснабжение, гормонов и т.д. Поэтому можно сказать, что беременность возможна, но вынашивание — нет.
Как женщинам предотвратить образование узлов?
Для профилактики образования субмукозных узлов надо отказаться от абортов, воздержаться от хирургических вмешательств и любой травматизации эндометрия, пытаться впервые забеременеть в возрасте до 30 лет. И обязательно хотя бы раз в год проходить полный осмотр у гинеколога.
Источник
Субмукозная миома матки
Субмукозная миома — доброкачественная гормонозависимая опухоль, расположенная в подслизистом слое матки и образованная гладкомышечными клетками миометрия. Почти в половине случаев протекает бессимптомно. Может проявляться меноррагиями, нарастающей анемией, схваткообразными болями внизу живота во время менструации, невозможностью забеременеть или выносить ребенка. Для диагностики заболевания используют трансвагинальное УЗИ, гидросонографию, гистероскопию, допплерографию и ангиографию малого таза. В зависимости от особенностей течения выбирают один из методов консервативного, комбинированного, хирургического органосохраняющего или радикального лечения.
Общие сведения
Субмукозную или подслизистую миому (лейомиому) диагностируют в 32% от всех случаев выявления миоматозных узлов. Заболевание поражает женщин репродуктивного возраста и никогда не возникает у девочек до наступления первой менструации. Чаще выявляется у пациенток в возрасте 33-40 лет. В последние годы намечается тенденция к «омоложению» патологии и обнаружению субмукозных узлов у больных 20-25 лет. После наступления климакса подслизистые миомы обычно не развиваются, а уже существующие узлы регрессируют. Существует тесная взаимозависимость между заболеванием и проблемой бесплодия — у каждой пятой женщины, которая не может забеременеть, наличие миоматозных узлов является единственной патологией репродуктивной системы.
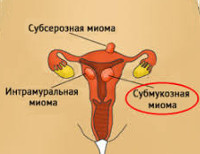
Субмукозная миома матки
Причины субмукозной миомы
Наиболее вероятными причинами возникновения подслизистых узлов являются гормональный дисбаланс и изменение чувствительности гладкомышечных клеток миометрия к действию женских половых гормонов. К развитию субмукозной лейомиомы могут привести:
- Наследственная предрасположенность. Пролиферацию клеток миометрия провоцирует генетически обусловленное изменение их чувствительности к эстрогену и прогестерону.
- Гипоталамо-гипофизарные нарушения. Гормональный дисбаланс возникает при изменении уровня фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов. Расстройство может наблюдаться при сосудистых и травматических повреждениях головного мозга, значительных психоэмоциональных нагрузках.
- Изменение эндокринной функции яичников. Уровень секреции эстрогена, прогестерона и нормальное соотношение между этими гормонами нарушается при воспалительных заболеваниях (оофорите, сальпингите, аднексите), травме, опухолях.
- Травматическое повреждение миометрия. Чувствительность гладкомышечных клеток изменяется из-за частых абортов, инвазивных лечебных и диагностических процедур.
- Действие экстрагенитальных факторов. Нарушение выработки женских половых гормонов наблюдается при сахарном диабете, поражении щитовидной железы, некоторых других эндокринных заболеваниях. Уровень эстрогена в крови может повышаться на фоне ожирения, поскольку клетки жировой ткани способны продуцировать этот гормон.
- Неконтролируемый прием гормональных контрацептивов. При длительном использовании контрацептивных препаратов может нарушаться секреция половых гормонов, регулирующих овуляторный цикл.
- Застой в малом тазу. По мнению ряда авторов, причинами гормонального дисбаланса является венозный застой из-за отсутствия регулярной сексуальной разрядки и сидячего образа жизни.
Стоит отметить, что далеко не во всех указанных ситуациях у женщин возникает субмукозная миома. Поэтому поиск пусковых факторов развития заболевания еще продолжается.
Патогенез
Сначала под влиянием провоцирующих факторов вблизи микрососудов в мышечном слое матки формируется активная зона, в клетках которой ускоряются обменные процессы, повышается тканевая проницаемость. В последующем гладкомышечные клетки этой зоны начинают скапливаться в микроскопически и макроскопически определяемые узлы. Со временем чувствительность пролиферирующей ткани к действию гормонов уменьшается, запускаются собственные аутокринопаракринные механизмы роста. Питание субмукозных миом обеспечивают сосуды, утратившие свою адвентициальную оболочку. Растущий подслизистый узел увеличивает площадь отторжения эндометрия и уменьшает способность миометрия к сокращению, что провоцирует более обильные, длительные и болезненные менструальные кровотечения.
Классификация
Подслизистые миомы отличаются количеством узлов, локализацией, размерами и строением. Для классификации заболевания используются следующие критерии:
- Количество узлов. Различают одиночные и множественные субмукозные миомы.
- Размеры. Подслизистые опухоли размером до 20 мм (до 4-5 недель беременности) считаются маленькими, от 20 до 60 мм (от 4-5 до 10-11 недель) — средними, больше 60 мм (12 недель и более) — большими.
- Место расположения. В большинстве случаев новообразования локализуются в теле матки, в 5% — в области шейки.
- Морфология. В зависимости от типа клеток и активности их пролиферации выделяют простые подслизистые миомы, пролиферирующие узлы и предсаркомы.
Симптомы субмукозной миомы
Симптоматика зависит от давности возникновения, размеров и интенсивности роста узла. На начальных этапах симптомы обычно отсутствуют, новообразование становится случайной находкой при гинекологическом осмотре или УЗИ. Первым наиболее характерным признаком роста субмукозного узла является меноррагия — обильное менструальное кровотечение со сгустками крови, длительность которого превышает продолжительность обычной менструации. Кровянистые выделения также могут наблюдаться в межменструальный период. Из-за частных значительных кровопотерь развивается анемия с общим недомоганием, бледностью кожи, головокружениями, головными болями, снижением работоспособности.
Боли при субмукозном расположении узла, по данным специалистов в сфере гинекологии, наблюдаются у 20-50% пациенток. Они обычно возникают во время менструации, носят схваткообразный характер, локализуются в нижней части живота и могут отдавать в поясницу. В отличие от субсерозной миомы, подслизистая опухоль обычно не влияет на расположенные рядом органы. В 10-40% случаев отмечается нарушение репродуктивной функции — невозможность забеременеть или самопроизвольное прерывание беременности.
Осложнения
Субмукозная миома может осложняться массивными маточными кровотечениями, развитием выраженной анемии. При значительной деформации полости матки возрастает риск бесплодия, выкидышей, патологической беременности и родов. В 7-16% случаев узел подвергается сухому или влажному некрозу. При наличии восходящей инфекции подслизистая миома может нагноиться или абсцедировать, при этом у пациентки повышается температура, возникает озноб, боли внизу живота, изменяется общее состояние. Наиболее грозным осложнением является «рождение» подслизистого узла, которое сопровождается «кинжальными» схваткообразными болями внизу живота, кровотечением, риском инфицирования. Злокачественное перерождение опухоли отмечается редко (в 1,5-3% случаев заболевания).
Диагностика
Поскольку клиническая симптоматика при субмукозной миоме неспецифична и выражена не у всех пациенток, важную роль в диагностике играют физикальные и инструментальные исследования. В план обследования обычно включают:
- Осмотр гинеколога. При бимануальной пальпации выявляется увеличенная матка.
- Трансвагинальное УЗИ, гидросонографию, допплерографию. Методики позволяют определить размеры, тип и структуру узлов, выявить патологию эндометрия, оценить толщину гладкомышечного слоя и интенсивность кровотока.
- Гистероскопию. В матке обнаруживают овальное или округлое образование с гладкой бледно-розовой поверхностью либо множественные узлы на ножках, свисающие в виде «гроздьев» в ее полость.
- Ангиографию органов малого таза. Визуализация кровеносной системы матки дает возможность подтвердить отсутствие неоваскуляризации своевременно дифференцировать доброкачественный узел от злокачественной неоплазии.
- Рентгенотелевизионную гистеросальпингографию. Выявляет изменение формы полости матки с участками просветления или дефектами наполнения. В настоящее время применяется редко.
- МРТ и КТ матки. Методы применяются для точной оценки топографии миоматозных узлов.
Поскольку для субмукозной миомы характерно развитие анемии, в общем анализе крови часто обнаруживается эритропения и снижение уровня гемоглобина. Заболевание необходимо дифференцировать от беременности, полипов, саркомы, внутреннего эндометриоза тела матки. При необходимости к обследованию привлекают онкогинеколога, эндокринолога.
Лечение субмукозной миомы
При выборе врачебной тактики учитывают возраст женщины, ее планы по сохранению репродуктивной функции, размеры, расположение и интенсивность роста узлов, выраженность клинической картины и наличие осложнений. Пациенткам с новообразованиями стабильных размеров при отсутствии меноррагий, болевого синдрома, сохраненной репродуктивной функции рекомендовано динамическое наблюдение с ежегодным осмотром гинеколога. В остальных случаях выбирают один из способов консервативного, комбинированного или хирургического лечения.
Медикаментозная терапия показана при опухолях размерами до 3 см, умеренных меноррагиях, медленном росте новообразований. Больным рекомендованы препараты, которые угнетают секрецию женских половых гормонов, устраняя одну из основных причин образования опухоли — гормональную стимуляцию роста. Такую терапию обычно дополняют симптоматическими средствами. Особенно эффективно консервативное лечение в пременопаузе, которая сменяется естественной менопаузой. Как правило, пациенткам назначают:
- Препараты, угнетающие секрецию гонадотропинов. При использовании антигонадотропинов и агонистов гонадотропных рилизинг-гормонов (А-ГнРТ) размеры узлов стабилизируются или даже уменьшаются, а кровопотеря при менструациях снижается.
- Оральные или внутриматочные гормональные контрацептивы. Показаны женщинам детородного возраста для стабилизации эффекта, достигнутого при угнетении секреции гонадотропинов.
- Гемостатики и препараты, сокращающие матку. Применяются для уменьшения кровопотери при меноррагиях.
- Общеукрепляющие средства. Для улучшения общего самочувствия назначаются витаминно-минеральные комплексы и препараты железа.
Комбинированное лечение — оптимальный вариант для пациенток, которые хотят сохранить репродуктивную функцию при наличии единичного узла или множественных образований размером от 50 мм с клинической симптоматикой и тенденцией к медленному росту. При этом методе назначение А-ГнРТ предваряет и завершает консервативную миомэктомию. Использование гормональных препаратов накануне вмешательства позволяет уменьшить размеры доброкачественных подслизистых узлов, снизить кровопотерю, сократить продолжительность операции и послеоперационного восстановления.
Хирургическое лечение рекомендовано, если узел достигает больших размеров (от 12 недель беременности), интенсивно растет (увеличение на 4-5 и более недель за год, особенно во время климакса и менопаузы), сопровождается нарастающей анемией, болями и развитием осложнений (в том числе бесплодия). В зависимости от течения заболевания и репродуктивных планов женщины могут быть выбраны следующие виды вмешательств:
- Органосохраняющие операции. Миоматозные узлы удаляют методом гистерорезектоскопии (трансцервикальной миомэктомии) с использованием механических, лазеро- или электрохирургических инструментов либо разрушают при помощи высокочастотного фокусированного ультразвукового воздействия (ФУЗ-абляции) или криомиолиза. Эмболизация маточных артерий позволяет ограничить питание опухоли и привести к ее рассасыванию.
- Радикальные вмешательства. При неблагоприятном течении заболевания женщине рекомендуют трансвагинальную, лапароскопическую, лапаротомическую дефундацию матки, субтотальную (надвлагалищную) или тотальную гистерэктомию.
Прогноз и профилактика
При своевременном выявлении и адекватном лечении прогноз субмукозной миомы благоприятный. В период менопаузы опухоль, как правило, регрессирует. Эффективность эмболизации маточных артерий составляет до 50%. Проведение органосохраняющих вмешательств позволяет восстановить репродуктивную функцию у женщин детородного возраста. Послеоперационный период в зависимости от объема операции и вида доступа длится от 7 до 24 дней. Срок диспансерного наблюдения после гистерэктомии составляет 5 лет, После миомэктомии из-за возможности развития рецидива женщины наблюдаются пожизненно. Основными методами профилактики заболевания являются рациональное назначение гормональных контрацептивов, ограничение инвазивных вмешательств, лечение заболеваний, при которых наблюдается гиперэстрогенемия.
Источник