Рубцовая деформация шейки матки в период менопаузы
Содержание статьи
Рубцовая деформация шейки матки
Рубцовая деформация шейки матки (РДШМ) — посттравматическое или врожденное нарушение анатомической формы шейки матки с несостоятельностью её цервикального канала. В большинстве случаев клиническая симптоматика выражена незначительно. Патология может проявляться наличием шеечных белей, диспареунией, тазовыми болями, увеличением длительности менструации. При постановке диагноза учитывают данные анамнеза, осмотра в зеркалах, кольпоскопии, цитоморфологических и лабораторных исследований. Для лечения используют хирургические методы: абляцию, трахелопластику, конизацию, трахелэктомию, наложение кругового шва.
Общие сведения
По данным различных исследований в сфере гинекологии, частота посттравматических и врожденных рубцовых изменений шейки матки составляет от 15,3 до 54,9%, при этом в репродуктивном возрасте она может достигать 70%. Заболевание чаще выявляют у женщин, впервые родивших ребёнка в возрасте старше 30 лет. У пациенток с цервицитами вероятность посттравматического замещения нормального эпителия рубцовой тканью возрастает. Высокая значимость профилактики, своевременной диагностики и лечения РДШМ обусловлена существенным влиянием заболевания на повышение риска развития бесплодия, воспалительных и онкологических процессов.
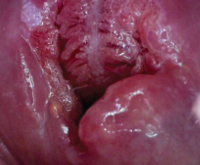
Рубцовая деформация шейки матки
Причины РДШМ
К формированию рубцов, нарушающих нормальную анатомическую структуру шейки матки, обычно приводят процессы и вмешательства, при которых повреждается эпителий с подлежащими мышцами и соединительной тканью. Наиболее распространёнными причинами рубцовой деформации являются:
- Патологические роды. Разрывы шейки возникают при стремительных родах с недостаточным раскрытием цервикального канала, наложении акушерских щипцов, крупном плоде или его неправильном положении. Вероятность повреждений в два раза выше у первородящих старше 30 лет.
- Инвазивные манипуляции. Во время абортов, лечебно-диагностических процедур и эндоскопических операций в полости матки и на её придатках врач вводит инструменты через цервикальный канал. При этом целостность эпителия нарушается.
- Ошибки при наложении швов. Процесс регенерации страдает при недостаточном или неправильном ушивании разрывов, возникших во время родов, или при грубом проведении инвазивных манипуляций.
Крайне редко деформация шейки рубцового типа является врождённой. В таких случаях заболевание обычно сопровождается патологией со стороны других органов женской половой сферы.
Патогенез
При формировании рубцовой деформации нарушается процесс физиологического восстановления участков повреждённого экзо- и эндоцервикса. Вместо эпителиальных клеток в зоне разрыва пролиферирует соединительная ткань. Вначале она является достаточно эластичной, но по мере формирования рубца уплотняется, теряет способность к растяжению и сокращению. В результате цервикальный канал замыкается не полностью и утрачивает свою защитную функцию. В повторных родах шейка матки с рубцовыми изменениями не может полностью раскрыться, что осложняет их течение. При глубоких разрывах края могут заживать в виде лоскутов. Несостоятельность цервикального канала сопровождается развитием эктропиона.
Классификация
При определении степени РДШМ учитывают такие критерии, как состоятельность наружного зева, количество и размеры рубцов, состояние эндо- и экзоцервикса, окружающих тканей. Различают четыре степени рубцовых деформационных изменений:
- I степень. Наружный зев пропускает кончик или весь палец врача. Цервикальный канал имеет форму конуса, вершиной которого является внутренний маточный зев. Глубина одиночных или множественных старых разрывов не превышает 2 см. Выявляются признаки эктропиона нижних отделов цервикального канала.
- II степень. Наружный маточный зев невозможно идентифицировать. Шейка матки «расщеплена» на отдельные переднюю и заднюю губу с распространением старых разрывов до сводов. Эндоцервикс полностью вывернут.
- III степень. Старые разрывы доходят до влагалищных сводов. Наружный зев не определяется. Одна из губ шейки гипертрофирована. Отмечается дисплазия эпителия и признаки воспалительного процесса.
- IV степень. Проявляется сочетанием старых разрывов, которые распространяются до сводов влагалища, с недостаточностью мышц тазового дна.
Симптомы РДШМ
При I степени РДМШ единственным признаком заболевания зачастую является увеличенное количество слизистых шеечных выделений. При рубцовой деформации II-IV степени некоторые пациентки жалуются на тянущие или ноющие боли внизу живота и в пояснично-крестцовой области. Присоединение инфекции сопровождается изменением цвета белей, которые становятся мутными, белесоватыми или жёлтыми. Цикличность менструаций обычно не нарушается, но их продолжительность может увеличиваться на 1-2 дня. В 13-15% случаев заболевания женщины отмечают болезненность во время полового акта. Одним из признаков рубцового деформационного процесса в области шейки является невозможность зачать или выносить ребёнка.
Осложнения
Рубцовая деформация часто осложняется присоединением вторичной инфекции с развитием хронического цервицита. Недостаточность защитной функции цервикального канала приводит к распространению воспалительного процесса на эндометрий, маточные трубы и яичники. Поскольку эндоцервикс постоянно подвергается воздействию кислой среды влагалища, резко возрастает вероятность развития эрозии, дисплазии, лейкоплакии, полипов, злокачественных опухолей. Рубцово-изменённая шейка матки в родах проявляет функциональную несостоятельность — естественные роды затягиваются или становятся невозможными. Заболевание является одной из причин шеечного бесплодия.
Диагностика
Рубцовые изменения в цервикальном канале и шейке матки можно предположить по наличию в анамнезе осложнённых родов или инвазивных процедур. Для подтверждения диагноза в план обследования включают:
- Гинекологический осмотр на кресле. При осмотре в зеркалах выявляется расширение наружного зева, старые разрывы, признаки эктропиона. Во время влагалищного исследования наружный зев проходим для пальца гинеколога.
- Кольпоскопию. Под микроскопом более детально изучается характер рубцовых изменений поверхности шейки матки и цервикального канала.
- Цитоморфологическое исследование. Цитология мазков и гистология биоптата позволяют оценить состояние клеток шейки, а также вовремя обнаружить перерождение тканей.
- Лабораторную диагностику. Для выявления специфических и неспецифических инфекционных агентов при наличии воспалительного процесса применяют серологические анализы, ПЦР и посев на флору.
Обнаружение грубых рубцовых изменений облегчает постановку диагноза. При наличии осложнений может потребоваться консультация онкогинеколога и дерматовенеролога.
Лечение РДШМ
Поскольку заболевание сопровождается анатомическими изменениями, для его лечения наиболее эффективны хирургические методы. Выбор конкретной методики определяется степенью деформации, репродуктивными планами женщины и наличием осложнений. Рекомендованы следующие виды операций:
- Абляционные методы. Для удаления рубцово-изменённых тканей, эктропиона, участков эндоцервикса с полипами, дисплазией или лейкоплакией применяют радиоволновое и аргоноплазменное лечение, лазерную вапоризацию, криодеструкцию, диатермокоагуляцию. Абляция эффективна при деформации I степени у пациенток репродуктивного возраста, планирующих беременность.
- Трахелопластика. В ходе реконструктивных операций методом частичного или полного расслоения удаляются рубцовые ткани при сохранении мышечного слоя и слизистой, восстанавливается цервикальный канал. Метод показан женщинам детородного возраста со II-III степенью рубцовой деформации.
- Конизация и трахелэктомия. Иссечение поражённых участков или ампутацию выполняют при сочетании деформации с интраэпителиальными неоплазиями или несостоятельностью мускулатуры тазового дна. Радикальные операции чаще проводят у пациенток, которые вышли из репродуктивного возраста.
- Наложение кисетных швов. При появлении признаков истмико-цервикальной недостаточности во время беременности запирающую функцию шейки матки восстанавливают механическим способом. Альтернативой проведению операции в таком случае может стать установка акушерского пессария.
Вспомогательные медикаментозные методы лечения направлены на купирование воспалительного процесса. После санации влагалища больным назначают препараты для восстановления его нормальной микрофлоры.
Прогноз и профилактика
Проведение реконструктивно-пластических операций в 90-93% случаев позволяет восстановить нормальную форму и функции шейки матки. Эффективность наложения кисетных швов беременным пациенткам с рубцовой деформацией, осложнившейся истмико-цервикальной недостаточностью, составляет от 70 до 94% (в зависимости от выбранной методики). Для профилактики заболевания рекомендуется обоснованное назначение инвазивных процедур, своевременная постановка на учёт при беременности, правильная подготовка к родам и их грамотное ведение. При наличии травматических разрывов важно их своевременное ушивание с последующим контролем у гинеколога.
Источник
Влагалище и шейка матки в постменопаузе.
Возможности терапии.
Проф. д.м.н. В.Н. Прилепская, руководитель научно-поликлинического отдела.
Научный центр акушерства, гинекологии и перинатологии РАМН
Проблема постменопаузы приобрела в последние годы особое значение в связи со значительным увеличением продолжительности жизни женщин, что особенно четко прослеживается в развитых странах. Однако тот период жизни, за счет которого увеличивается эта продолжительность, характеризуется возрастными инволютивными изменениями, нередко выходящими за рамки физиологических процессов старения, развитием ряда патологических симптомов, синдромов и заболеваний.
На фоне дефицита половых гормонов, преимущественно эстрогенов, у каждой второй женщины возникают климактерические нарушения, которые по времени их возникновения и клиническим особенностям условно принято разделять на 3 группы.
1-я группа — ранние (вазомоторные) симптомы (приливы жара, повышение потливости, головная боль, гипотония или гипертония, учащенное сердцебиение) и эмоционально-психические (раздражительность, сонливость, невнимательность, снижение либидо).
2-я группа — средне-временные урогенитальные нарушения (сухость во влагалище, боль при половом сношении, зуд и жжение, цисталгия, недержание мочи).
3-я группа — поздние обменные нарушения (остеопороз, сердечно-сосудистые заболевания).
Симптомы урогенитальных нарушений возникают приблизительно через 5 лет и более после прекращения менструаций и в дальнейшем прогрессируют, приводя к функциональным и анатомическим изменениям не только влагалища, уретры, мочевого пузыря, мочеточников, но и патологическим процессам шейки матки.
Дефицит эстрогенов закономерно вызывает нарушение пролиферативных процессов влагалищного эпителия, подавление митотической активности клеток, в первую очередь базального и парабазального слоев, изменение чувствительности рецепторного аппарата. Как известно, специфическая регуляция влагалища определяется рецепторами к эстрогенам, протеинами, альтернативными гормонами, клеточными элементами иммунокомпетентных клеток. По мере прогрессирования эстрогенного дефицита на фоне общих инволютивных изменений в организме происходит значительное изменение микроциноза влагалища.
Известно, что у женщин репродуктивного возраста в микроцинозе влагалища преобладают пероксин-продуцирующие лактобациллы, которые обеспечивают защитные свойства влагалища, конкурируя с патогенными микроорганизмами.
Путем расщепления гликогена, образующегося в эпителии влагалища благодаря наличию достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду в пределах колебания рН от 3, 8 до 4, 4.
Это в свою очередь приводит к подавлению роста патогенных и условно-патогенных бактерий. Наряду с присущими ей защитными свойствами влагалищная флора у женщин репродуктивного возраста обладает достаточно выраженной ферментативной, витаминообразующей, иммуностимулирующей и другими функциями, необходимыми для нормального функционирования экосистемы и ее защитного действия.
В период постменопаузы эти защитные свойства утрачиваются, слизистая оболочка влагалища истончается, легко изъязвляется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами. По мере прогрессирования дефицита эстрогенов, нарастают и атрофические изменения во влагалище, которые характеризуются:
— снижением кровотока и кровоснабжения;
— фрагментацией элластических и гиалинозом коллагеновых волокон;
— уменьшением содержания гликогена в клетках эпителия влагалища;
— снижением колонизации лактобацилл;
— значительным снижением количества молочной кислоты;
— повышением рН влагалища до 5,5 — 6,8.
С увеличением продолжительности постменопаузы происходит резкое ощелачивание влагалищной среды, развитие дисбиотических и атрофических процессов.
Атрофические процессы, особенно выраженные в слизитой влагалища, захватывают и соединительнотканные и мышечные структуры влагалища, мышцы тазового дна, уретры, мочевого пузыря, что закономерно приводит как к анатомическим, так и функциональным нарушениям мочеполовой системы.
Многослойный плоский эпителий, покрывающий наружную поверхность влагалищной части шейки матки (экзоцервикс), претерпевает аналогичные изменения с прогрессирующими явлениями атрофии.
В виду этого наиболее частыми клиническими формами возрастной патологии влагалища и шейки матки в постменопаузе являются атрофические вагиниты (кольпиты) и цервициты.
Наиболее тяжелые формы атрофических изменений нижних отделов половых путей связаны с нарушением контроля мочеиспускания, требуют обследования не только гинеколога, но и уролога и подробно изложены в диссертации В. Е. Балан (1998) [1].
Клиническими проявлениями атрофических вагинитов и цервицитов являются весьма характерные жалобы на сухость, зуд, выделения из влагалища, носящие длительный, рецидивирующий и упорный характер, кровянистые выделения при физической нагрузке и половых контактах, при попытке произвести исследование в зеркалах; различные сексуальные нарушения, вплоть до невозможности половой близости.
Схематично динамику сексуальных нарушений можно представить следующим образом: вначале появляется сухость влагалища, снижение коитальной, а затем и сексуальной активности, снижение оргазма и возбуждения, диспареуния и впоследствии невозможность половых контактов.
Диагностика и дифференцированная диагностика возрастных изменений нижних отделов половых путей в первую очередь должна быть направлена на исключение онкологической, инфекционной и других патологий, которые могут как бы маскироваться возрастными изменениями.
Основными методами исследования, которые безусловно не исчерпывают весь арсенал методов и могут быть необходимы для обследования конкретной больной, являются:
— клинический метод;
— расширенная кольпоскопия;
— кольпоцитология (с определением КПИ или ИС мазков) ;
— Pap-smear-test (мазки-отпечатки с шейки матки);
— бактериоскопический;
— бактериологический;
— определение рН влагалищного содержимого.
Клиническому методу исследования должно отводится первостепенное значение, несмотря на наличие комплекса перечисленных дополнительных методик.
Важное значение имеют связь с возрастом больных, характерные клинические признаки в виде вульвитов, вагинитов, экзо- и эндоцервицитов, дистрофических процессов вульвы и влагалища. При этом необходимо помнить, что характерными особенностями клинического течения возрастных изменений нижнего отдела половых путей у женщин в постменопаузе является их длительное, рецидивирующее течение, сочетание с урологическими симптомами, отсутствие эффекта от антибактериальной и других видов терапии, не включающих применение эстрогенов в том или ином виде.
Особенностью клинического течения возрастной патологии является нередкое инфицирование истонченных и атрофических тканей.
В таком случае на первый план выступают симптомы того или иного инфекционного процесса (кандидоз, хламидиоз и т. д. ).
Однако, учитывая то, что беспорядочные половые связи у женщин в постменопаузе очень редки, редка и частота специфических процессов в половых органах.
Следует отметить, что основная ошибка в ведении этого контингента больных состоит в назначении длительной, немотивированной, бесконтрольной антибиотикотерапии, противовирусного и других видов лечения, приводящих к усугублению выраженности и извращенному характеру инволютивных изменений.
Клинические ошибки связаны также с необходимостью больных обращаться к врачам различных специальностей: акушеру-гинекологу, урологу, терапевту, дерматологу и, наконец, к психиатру.
В своей клинической практике мы встречали больных, которые в течение нескольких лет получали массивные дозы антибактериальной терапии по поводу атрофических вагинитов и цервицитов с неоднократной биопсией шейки матки, так как очаговые атрофические экзоцервициты трактовались как подозрение на предраковые процессы.
Трудно переоценить значимость кольпоскопии при оценке состояния шейки матки в постменопаузе.
Как правило, кольпоскопическая картина шейки матки в постменопаузе является достаточно характерной: многослойный плоский эпителий истончен, субэпителиальные сосуды стромы легко кровоточат при контакте и могут не сокращаться на пробу с раствором уксусной кислоты; стык многослойного плоского и цилиндрического эпителия находится на уровне наружного зева, определяется картина синильного диффузного или очагового экзоцервицита, проба Шиллера слабоположительная.
При кольпоцитологии в постменопаузальном периоде выявляются 5 основных типов влагалищных мазков:
— пролиферативный;
— промежуточный;
— смешанный;
— атрофический;
— цитолитический.
Пролиферативный и промежуточные типы мазков могут редко встречаться в менопаузе или в начале постменопаузы, смешанный, атрофический или цитолитический тип наиболее часто встречающиеся типы мазков.
О выраженном дефиците эстрогенов свидетельствуют мазки атрофического и цитолитического типа, которые встречаются у 63 — 68% женщин с продолжительностью менопаузы более 5 лет.
Подсчет кариопикнотического индекса и индекса созревания позволяет более точно определить степень эстрогенных влияний, вернее, эстрогенного дефицита. В постменопаузе он не превышает 15 — 20% и колеблется от 0 (выраженный дефицит) до 20 (умеренный дефицит).
Чрезвычайно важным в отношении онкологической настороженности применительно к патологии шейки матки является Pap-smear-test, позволяющий с точностью до 95% выявить предраковые процессы шейки матки, не выявляемые с помощью других неинвазивных методик. Мазки-отпечатки с шейки матки по Папаникалау подразделяются на 5 основных классов.
При получении ответа цитолога о выявлении IV или V класса мазков следует тщательно обследовать больную для исключения признаков цервикальной неоплазии. Нередко это подозрение при повторной кольпоскопии исчезает после проведения противовоспалительного лечения. Если нет-показана прицельная биопсия шейки матки с последующим цитологическим исследованием биоптата.
Бактериоскопический и бактериологический методы позволяют выявить состояние микрофлоры влагалища, специфических и неспецифических возбудителей сопутствующей инфекции, дисбиотические процессы влагалища.
По данным А.С. Анкирской (1995) [2], у женщин в постменопаузе атрофические процессы нередко осложняются бактериальным вагинозом, одним из признаков которого является наличие «ключевых» клеток во влагалищном мазке.
Дополнительным методом диагностики состояния микробиоценоза является определение рН влагалищного содержимого с помощью бумажных индикаторов или биохимических методов.
Установлено, что не только уровень КПИ, но и уровень рН могут быть использованы для косвенного суждения о степени эстрогенной недостаточности. Если у здоровых женщин рН колеблется от 3,5 до 5,5, то в период постменопаузы от 5,5 до 7, при этом рН > 6 соответствует значительной выраженности атрофических процессов (Муравеева В.В., 1997) [3].
Безусловно, одним из первых методов обследования пациенток является УЗИ гениталий, позволяющее исключить органическую патологию половых органов.
Таким образом, только комплексное исследование позволяет оценить состояние нижнего отдела половых путей и принять решение об использовании заместительной гормонотерапии (ЗГТ).
В настоящее время не вызывает сомнений, что ЗГТ — основной метод лечения вульвитов, вагинитов, цервицитов, сексуальных и урологических нарушений, обусловленных дефицитом эстрогенов. При этом следует учитывать, что невосполненный эстрогенный дефицит прогрессирует с увеличением продолжительности менопаузы. Существует такое понятие как «терапевтическое окно», продолжительность которого условно исчисляется 8 — 10 годами наступления менопаузы.
Начатая в этот период своевременная терапия ранневременных климактерических расстройств позволяет значительно уменьшить выраженность и отсрочить появление средневременных атрофических нарушений.
Основными задачами ЗГТ у данного контингента женщин являются :
1) ликвидация атрофических изменений, восстановление нормальной микрофлоры влагалища, кровообращения, тонуса влагалища и мочевыводящих путей;
2) предотвращение инфицирования влагалища и шейки матки, что осуществляется с помощью эстрогенов, входящих в состав различных препаратов как системного, так и местного действия.
Принципы выбора того или иного метода ЗГТ у женщин с атрофическими процессами в постменопаузе, особенно при нарушении контроля мочеиспускания детально сформулированы В.Е. Балан, В.П. Сметник в ряде статей [4].
При изолированных, не сочетающихся с другими симптомами менопаузы, урогенитальных расстройствах и наличии противопоказаний к системной ЗГТ у женщин старше 65 лет предпочтение следует отдавать местной терапии препаратами, содержащими эстриол, не вызывающими каких-либо осложнений в отличие от системной ЗГТ (климен, прогинова, циклопрогинова, ливиал, дивина, дивитрен и многие другие), практически безопасными и не имеющими абсолютных противопоказаний.
Применительно к инволютивной патологии вульвы, влагалища и шейки матки местную терапию мы считаем методом выбора.
В нашей стране, так же как и за рубежом, предпочтение отдается препаратам эстриола, входящего в состав таблеток, кремов, мазей, свечей под названием «Овестин».
Эстриол имеет самый короткий период нахождения в ядре клетки (1 — 4 ч) и обладает самой низкой биологической активностью среди естественных эстрогенов, что определяет его преимущество как препарата локального действия. В отличие от других эстрогенов он связывается с рецепторами нижнего отдела половых путей значительно быстрее, чем с рецепторами матки, в связи с чем не вызывает пролиферацию эндометрия, что чрезвычайно важно у больных в периоде постменопаузы.
Менструальноподобная реакция при его применении в отличие от других препаратов возникает чрезвычайно редко.
Вместе с тем под влиянием уже небольших доз препарата активизируются пролиферативные процессы влагалищного и шеечного эпителия, нормализуется микрофлора влагалища, повышается тонус сосудов, мышц, улучшается кровообращение нижних отделов половых путей, в связи с чем повышается резистентность влагалища и шейки матки к инфекционным воздействиям.
Мы имеем опыт применения овестина у 283 больных в различных лекарственных формах на протяжении от 1 года до 5 лет [5]. Ретроспективный анализ показал его высокую клиническую эффективность также и в качестве реабилитирующего средства после лечения специфических инфекционных процессов у женщин в постменопаузе. Существуют различные схемы применения препарата, мы использовали одну из следующих:
Овестин (свечи) — по 1 свече (0, 5 мг) 1 раз в день в течение 3 нед, затем по 1 свече 2 раза в неделю в течение 3 нед, затем по 1 свече 1 раз в неделю.
Овестин (крем) — 1 доза (0, 5 мг) 1 раз в день в течение 3 нед; 1 доза 2 раза в неделю в течение 3 нед; 1 доза 1 раз в неделю.
Далее — минимальная поддерживающая доза под контролем КПИ, который должен находится на показателях 10 — 15%.
В тех случаях, когда при обследовании пациентки выявляется инфекционный процесс влагалища и шейки матки специфической или неспецифической этиологии, необходимо проведение этиотропной терапии: при кандидозе — местное или системные антимикотики, при бактериальном вагинозе — далацин-вагинальный крем + антимикотики и т. д.
После контрольного микробиологического исследования, исключающего наличие патогенной микрофлоры, показано использование овестина по той же схеме с клиническим и лабораторным контролем с применением перечисленных ранее дополнительных методов исследования, позволяющих судить о степени восполнения эстрогенного дефицита.
В настоящем сообщении мы хотели коротко остановиться на клинике, диагностике некоторых форм возрастных изменений в репродуктивной системе женщины и возможностях их коррекции с помощью методов щадящей терапии, чрезвычайно удобной для применения.
Однако изложенный кратко материал безусловно не охватывает все аспекты этой сложной и многогранной проблемы.
Другие публикации по материалам семинара дополнят и расширят настоящее сообщение.
Литература:
1. Балан В.Е. Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис. докт. мед. наук. — М., 1998. — 305 с.
2. Анкирская А. С. Бактериальный вагиноз // Акушерство и гинекология. — 1995. — Ь 6. — 13-16 с.
3. Муравьева В.В. Микробиологическая диагностика бактериального вагиноза у женщин репродуктивного возраста // Автореф. дис. канд. биол. наук. — М. 1997. — 23 с.
4. Балан В.Е., Сметник В.П. Урогенитальные расстройства в постменопаузе. — М., 1998 — 3-5 с.
5. Прилепская В.Н. Лечение урогенитальных нарушений у женщин в постменопаузе препаратом Овестин. (Проблемы здоровья женщин позднего и старшего возраста. Тезисы доклада.). — М., 1995. — 11-14 с.
Опубликовано с разрешения администрации Русского Медицинского Журнала.
Источник