Осложнения миомы на сердце
Содержание статьи
Осложнения при миоме матки
Обновлено: 09 Сентября 2020
Содержание статьи
Типичная реакция большинства женщин, у которых обнаружили миому матки, – страх. Страх перед бесплодием, калечащей операцией или «перерождением» узла во что-то нехорошее. В нашей клинике мы всегда стараемся дать пациенткам полную информацию об этом заболевании, избавить от ничем не обоснованных опасений. Помните: в абсолютном большинстве случаев, при своевременном обращении к врачу, миома матки не опасна! Она не перерождается в рак и хорошо поддается лечению современными малотравматичными методами. Как правило, осложнения развиваются у женщин, которые годами не ходят к гинекологу и не делают УЗИ. Какие проблемы в этом случае могут возникнуть и как их предотвратить?
Симптомы, которые не стоит игнорировать
Сначала несколько слов о симптомах миомы матки. Почему у одних женщин они есть, а у других нет?
Все дело в расположении миоматозных узлов и их размерах. Маленькие миомы, не растущие в полости матки или в ее сторону, как правило, ничем не выдают своего присутствия. Эти бессимптомные образования обнаруживают случайно во время УЗИ при плановом визите к гинекологу. Зачастую их и лечить не надо – достаточно динамического наблюдения. Другое дело, если узлы крупные, растут в полости матки или деформируют ее. В этих случаях, они начинают себя проявлять. Какие симптомы при этом возникают?
длительные обильные менструации;
боль и давление в низу живота;
увеличение размеров матки и живота;
частые позывы к мочеиспусканию;
запоры
Если вы обнаружили у себя эти симптомы, не тяните с обращением к гинекологу. В современных клиниках лечения миомы применяют малотравматичные методы, которые позволяют вылечить заболевание и не нарушить репродуктивную функцию женщины.
О причинах миомы матки: кто виноват?
К сожалению, причины развития миомы на сегодняшний день неизвестны. Однако это заболевание совершенно точно не связано с гормональным дисбалансом в организме женщины, как считалось ранее. Миома матки – локальная, а не системная патология. Каждый миоматозный узел развивается из одной поврежденной гладкомышечной клетки матки. Усиленное деление этой клетки запускает гормон прогестерон. Но точно ответить на вопрос, какие факторы повреждают клетки-предшественницы миомы, медицина пока не может.
Сторонники одной из существующих теорий считают, что повреждение клетки происходит из-за большого количества менструаций и малого количества беременностей. Также есть предположение, что дефект в клетках возникает еще во время внутриутробного периода, когда гладкомышечные клетки матки длительное время находятся в нестабильном состоянии. Развитию заболевания способствуют операции на матке, воспалительные заболевания, многочисленные выскабливания и аборты.
Методы диагностики миомы: ничего лишнего
Самые информативные методы диагностики миомы – УЗИ и МРТ (это исследование проводят при очень крупных узлах и матке). Оба метода позволяют с высокой точностью описать размер и локализацию миоматозных узлов, оценить особенности кровотока в этих образованиях. При субмукозных узлах (растущих в полость матки) назначают гистероскопию (полость матки исследуют крошечной камерой). Делать диагностическое выскабливание, исследовать кровь на гормоны, сдавать анализы на инфекции и онкомаркеры при миоме не нужно.
Осложнения миомы матки
К счастью, их не так много. По сути, миома матки может спровоцировать 3 основных осложнения:
железодефицитную анемию;
сдавливание соседних органов и нарушение их функции;
проблемы с наступлением и вынашиванием беременности.
Некоторые миомы могут стать причиной развития острой патологии – перекрута ножки узла. Теперь о каждом осложнении подробнее.
Железодефицитная анемия: скрытая опасность
При каких миомах чаще всего развивается железодефицитная анемия?
при крупных узлах, увеличивающих размер матки;
узлах, располагающихся в полости матки (субмукозные миомы);
миомах, растущих в сторону полости матки (интрамуральные миомы с центрипетальным ростом).
Перечисленные миоматозные узлы практически всегда проявляют себя длительными обильными менструациями. Из-за ежемесячных больших кровопотерь у женщины снижается уровень гемоглобина в крови, постепенно развивается железодефицитная анемия. Это коварное нарушение, при котором страдает множество органов и систем. Испытывая кислородное голодание, они не могут работать в полную силу.
Основные проявления железодефицитной анемии:
головокружения
слабость и общее недомогание
ломкость ногтей
обильное выпадение волос
нарушение работоспособности
учащенное сердцебиение
одышка
снижение настроения
необъяснимая усталость и упадок сил.
Проблема в том, что железодефицитная анемия часто протекает скрытно, почти неощутимо. Женщина не всегда может объективно оценить объем своих кровопотерь во время менструации. А изменения в самочувствии привычно списывает на усталость. Единственный надежный способ вовремя выявить анемию и оценить скрытые кровопотери при миоме — сделать общий анализ крови и исследовать показатели железа и ферритина (комплекс белков, который показывает уровень запаса железа в организме). Выявленная железодефицитная анемия — показание к лечению миомы, даже если других проявлений заболевания нет.
Нарушение функции близлежащих органов
Большие миомы могут давить на соседние органы — мочевой пузырь, прямую кишку, крупные венозные стволы (в частности, полую вену). В результате у женщины появляются так называемые компрессионные симптомы: частые позывы к мочеиспусканию, запоры, тромботические осложнения и т.д. В этой ситуации обычно рекомендуется хирургическое лечение миоматозных узлов (миомэктомия) или эмболизация маточных артерий (ЭМА).
Нарушение репродуктивной функции
Некоторые миоматозные узлы мешают зачатию и вынашиванию плода. Прежде всего, это миомы, растущие в полости матки или деформирующие ее. Размер узла в данной ситуации значения не имеет – создать проблемы могут даже небольшие миомы. Такие образования способны сдавливать маточные трубы и мешать перемещению оплодотворенной яйцеклетки в полость матки. Узлы, деформирующие полость матки, во время беременности начинают активно расти и занимают пространство, в котором должен развиваться эмбрион. Крупные узлы (больше 3-4 см), растущие в стенке матки, могут вступать в конкурентные взаимоотношения с плодом, «обкрадывая» его и оттягивая на себя кровоток. Не получая достаточного количества кислорода и питательных веществ, плод не может нормально развиваться. Как следствие – замершая беременность и самопроизвольный выкидыш. Осложнить течение беременности могут и крупные (более 3 см) узлы на тонком основании (другое их название – узлы «на ножке»). Они способны спровоцировать развитие осложнения, требующего срочного хирургического вмешательства.
Миоматозные узлы, о которых идет речь, нужно обязательно лечить до наступления беременности. Выбор метода зависит от размера узлов, их количества и расположения. Так, например, если образование локализуется в полости матки, применяют гистерорезектоскопию (узел удаляется через влагалище, без разрезов стенок брюшной полости). Узлы «на ножке» можно удалить через маленькие разрезы в брюшной стенке (лапароскопическая миомэктомия). При небольших миомах, прилегающих к полости матки, возможно медикаментозное лечение препаратом «Эсмия». Он блокирует выработку прогестерона – основного гормона, стимулирующего рост миомы. У пациенток, планирующих беременность, применяется и эмболизация маточных артерий. Ее оптимально использовать при множественных миоматозных узлах. Если прибегнуть в этой ситуации к хирургическому лечению, на матке останется много рубцов, которые могут вызывать осложнения во время беременности и при родах.
Перекрут ножки миоматозного узла
Это осложнение, требующее экстренного хирургического вмешательства, провоцируют крупные субсерозные миоматозные узлы на тонком основании (узлы «на ножке»). При физической нагрузке, поднятии тяжестей, интенсивных занятиях спортом или половом контакте может произойти перекрут ножки узла. В результате пережимаются артерии, питающие наружную стенку ножки (серозную оболочку), в ней происходят процессы, которые могут привести к отделению узла, развитию перитонита и сепсиса.
Некроз миоматозных узлов
Периодически случается, что миоматозный узел в процессе своего роста, сдавливает сосуды, которые питают его изнутри, нарушает собственное кровоснабжение и погибает. В узле развивается локальный некроз, неопасный для окружающей ткани. У женщины в этот период может повыситься температура, возникают боли в низу живота, которые проходят самостоятельно или после приема обезболивающих средств. Все эти неприятные симптомы длятся около недели.
Многие врачи ошибочно считают, что некроз в миоматозном узле чреват воспалением матки и перитонитом. В результате женщину госпитализируют и проводят лечение, восстанавливающее кровоснабжение миоматозного узла. То есть, по сути, «спасают» миому вместо того, чтобы дать ей спокойно погибнуть. В этой ситуации лечить ничего не надо – женщине необходимо только адекватное обезболивание. Самостоятельное нарушение питания миоматозного узла и развитие в нем локального некроза – не осложнение, а благоприятный исход заболевания. Похожий механизм заложен в одном из самых эффективных методов лечения миомы – эмболизации маточных артерий.
О «перерождении» миомы в рак
Перерождение миомы из доброкачественной опухоли в злокачественную – это еще один стереотип, не имеющий ничего общего с реальностью. В настоящее время есть достоверные научные доказательства того, что миома не перерождается в злокачественную опухоль и не увеличивает риск развития онкологических заболеваний матки. Очень редкая злокачественная опухоль матки (лейомиосаркома) не связана с наличием миомы. Она развивается, как самостоятельное заболевание.
Профилактика осложнений миомы матки
Существует только один доказанный способ профилактики миомы матки – это длительный прием гормональных контрацептивов. По данным разных исследований, риск развития миомы в этом случае снижается на 17-30%. Однако гораздо более надежный способ предотвратить последствия и осложнения миомы – ежегодное прохождение УЗИ у гинеколога. Эта простая мера поможет вовремя выявить заболевание в его начальных проявлениях и остановить дальнейший рост узлов с помощью медикаментозного лечения.
ЭМА для предотвращения осложнений миомы
Эмболизация маточных артерий позволяет навсегда остановить рост миоматозных узлов и сохранить женщине возможность иметь детей. Принцип метода заключается в прекращении кровоснабжения миомы. Чтобы достичь этого эффекта, в периферические ответвления маточной артерии, которые располагаются внутри узлов, вводятся эмболизационные частицы (крошечные шарики из инертного полимера). Лишившись кровоснабжения, миоматозные узлы погибают и замещаются соединительной тканью. Эффективность ЭМА, по данным разных исследований, составляет 94-99%. Процедура занимает не более 15-20 минут, безболезненна и легко переносится. Реабилитация после ЭМА короче, чем после хирургических методов и риски осложнений несравнимо ниже.
Эмболизация маточных артерий успешно применяется для лечения миомы матки уже более 20 лет. Борис Юрьевич Бобров – эндоваскулярный хирург нашей клиники – один из первых специалистов, который освоил и внедрил этот метод в России.
Если у вас остались вопросы, вы хотите получить рекомендации об оптимальной тактике лечения миомы матки, врачи нашего экспертного совета проконсультируют вас бесплатно в режиме онлайн (заполните анкету ниже).
Список литературы:
- Савицкий Г. А., Иванова Р. Д., Свечникова Ф. А. Роль локальной гипергормонемии в патогенезе темпа прироста массы опухолевых узлов при миоме матки //Акушерство и гинекология. – 1983. – Т. 4. – С. 13-16.
- Сидорова И.С. Миома матки (современные аспекты этиологии, патогенеза, классификации и профилактики). В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2003; 5—66.
- Мериакри А.В. Эпидемиология и патогенез миомы матки. Сиб мед журн 1998; 2: 8—13.
- Бобров Б.Ю. Эмболизация маточных артерий в лечении миомы матки. Современное состояние вопроса // Журнал акушерства и женских болезней. 2010. №2. С. 100-125
- Б. Ю. Бобров, С. А. Капранов, В. Г. Бреусенко и др. Эмболизация маточных артерий: современный взгляд на проблему. «Диагностическая и интервенционная радиология» том 1 № 2 / 2007
Эндоваскулярный хирург, кандидат медицинских наук, самый большой персональный опыт ЭМА в России
Гинеколог, кандидат медицинских наук
Акушер-гинеколог, онколог, кандидат медицинских наук
Врач акушер-гинеколог
Источник
Ишемическая болезнь сердца и миома тела матки: клиническое наблюдение пациентки с сочетанной патологией
Введение
Миома тела матки (МТМ) представляет собой гормонозависимое опухолеподобное доброкачественное заболевание, возникающее из гладкомышечных структур маточной стенки. По данным различных источников, у 30–70% женщин в периоде менопаузального перехода имеется МТМ [1–7]. Однако истинная распространенность этого заболевания в популяции, вероятно, недооценена из-за отсутствия данных о распространенности опухолей без клинической симптоматики. Симптоматическая МТМ может вызывать боли в области таза, поясницы, диспептические явления, обильные менструальные кровотечения, а также осложненные роды и бесплодие [8].
К установленным факторам риска (ФР) МТМ относятся возраст, раннее наступление менархе, отсутствие родов в анамнезе, поздний возраст первой беременности, синдром поликистозных яичников [1]. Артериальная гипертензия, сахарный диабет, образ жизни (курение и др.) и ожирение [9] одновременно являются распространенными ФР сердечно-сосудистых заболеваний (ССЗ) и связаны с развитием атеросклероза [10]. Общие паттерны подтверждают предположение о том, что развитие атеросклеротических бляшек и МТМ имеют общий биологический механизм. Помимо этого, пролиферация гладкомышечных клеток моноклонального происхождения имеет решающее значение в развитии и атеросклероза, и МТМ [11].
С-реактивный белок (СРБ) служит характерным воспалительным предиктором атеросклероза. Повышение уровня СРБ может указывать на субклинический атеросклеротический процесс [12]. Гипергомоцистеинемия, являясь независимым ФР развития атеросклероза, может привести к усилению окислительного стресса, угнетению синтеза оксида азота, пролиферации гладких мышц, дисфункции эндотелия и тромбозу [13]. Повышение концентрации гомоцистеина от легкой до умеренной степени связано с повышенным риском развития атеросклеротических сосудистых заболеваний. Кроме того, гипергомоцистеинемия была предложена в качестве ФР эстроген-индуцированного онкогенеза. В исследовании Y. He et al. уровень СРБ был положительно связан с риском развития МТМ. В этом же исследовании была выявлена обратная связь между уровнем гомоцистеина и развитием МТМ, данная корреляция исчезла после хирургического удаления миомы [14].
В настоящее время в Российской Федерации ишемической болезнью сердца (ИБС) страдают 15–17% взрослого населения, причем после 30 лет ИБС выявляется у 30% женщин [15]. По данным зарубежных авторов, распространенность МТМ варьирует в пределах 20–40% [16, 17]. Однако на сегодняшний день нет данных о распространенности сочетанной патологии (ИБС и МТМ) в общей популяции. Назначение дезагрегантной, а в отдельных случаях антикоагулянтной терапии при проведении чрескожных коронарных вмешательств (ЧКВ) у пациенток с МТМ должно настораживать относительно повышенного риска кровотечений.
Аномальное маточное кровотечение является распространенным состоянием и часто сопутствует МТМ. В ретроспективном исследовании A. Själander et al. частота жалоб на обильные маточные кровотечения в группе исследуемых увеличилась с 17,8% до 29,5% после назначения антикоагулянтной терапии. Аномальные маточные кровотечения усугубляются не только при приеме антагонистов витамина К, но и при комбинированной дезагрегантной терапии [18]. Помимо этого, при назначении новых пероральных антикоагулянтов по поводу фибрилляции предсердий в периоде менопаузального перехода не оценивается их безопасность в отношении маточных кровотечений. В дополнение к этому долгосрочные последствия маточных кровотечений при моно- или двойной дезагрегантной терапии (ДДТ) часто игнорируются или недооцениваются. В частности, ДДТ, назначенная после ЧКВ, может приводить к обильному маточному кровотечению, увеличивая риск анемии, что особенно опасно для пациенток с установленной ИБС [19, 20].
Клиническое наблюдение
Пациентка Ю., 1970 г. р., поступила в отделение кардиологии медико-санитарной части ФГАОУ ВО «Казанский (Приволжский) федеральный университет» с жалобами на боли в прекардиальной области (за грудиной, в 3–4-м межреберьях слева), иррадирующие в спину при физической нагрузке (ходьбе, подъеме по лестнице на 1–2 этажа), купирующиеся в покое, повышение артериального давления до 160/90 мм рт. ст., общую слабость, периодические боли в низу живота, обильные менструации.
Anamnesis morbi et vitae
Вышеуказанные жалобы беспокоят пациентку около 2 лет. Ранее наблюдалась у кардиолога с диагнозом ИБС, стенокардия напряжения, функциональный класс II. Амбулаторно принимает периндоприл 2 мг/сут, розувастатин 20 мг/сут. Последние 2 мес. отмечает значительное снижение толерантности к физической нагрузке. Инсульты, инфаркты отрицает, гиперхолестеринемия выявлена около 4 лет назад. Вредные привычки отрицает. Амбулаторно проведена мультиспиральная компьютерная томография коронарных артерий (МСКТ), по данным которой выявлены критические стенозы правой коронарной артерии (ПКА). Находилась на диспансерном учете в женской консультации по поводу МТМ с 2005 г., наблюдался прогрессивный рост. Трижды проведены диагностические выскабливания полости матки по поводу гиперпластических процессов эндометрия (подтвержденных гистологически), от радикальных оперативных вмешательств в гинекологических отделениях пациентка отказывалась в связи с ИБС. Амбулаторно был назначен агонист гонадотропин-рилизинг-гормона № 6, с последующей установкой внутриматочной системы с левоноргестрелом.
Госпитализирована в отделение кардиологии в плановом порядке.
Предварительный клинический диагноз
Основное заболевание: ИБС. Стенокардия напряжения, функциональный класс III. Атеросклероз коронарных артерий (по данным МСКТ-коронарографии). Гипертоническая болезнь III степени, риск 4.
Осложнения: хроническая сердечная недостаточность
I стадии (функциональный класс III).
Сопутствующее заболевание: множественная интерстициально-субсерозная МТМ с геморрагическим синдромом.
Результаты обследования и лечения
С учетом сопутствующего диагноза совместно кардиологом и гинекологом принято решение о первичном проведении коронароангиографии (КАГ) и дальнейшей тактике лечения.
КАГ: тип коронарного кровоснабжения миокарда — правый. При ангиографии левой коронарной артерии (ЛКА) выявлены стенозы в пределах 35–40%, межсистемные коллатерали в дистальные отделы ПКА (рис. 1 А). При ангиографии ПКА выявлены: стеноз устья 80%, критический стеноз проксимального сегмента, функциональная окклюзия с уровня медиального сегмента (рис. 1 В). С учетом результатов КАГ принято решение о проведении ЧКВ на ПКА на первом этапе лечения и эмболизации маточных артерий (ЭМА) на втором этапе.
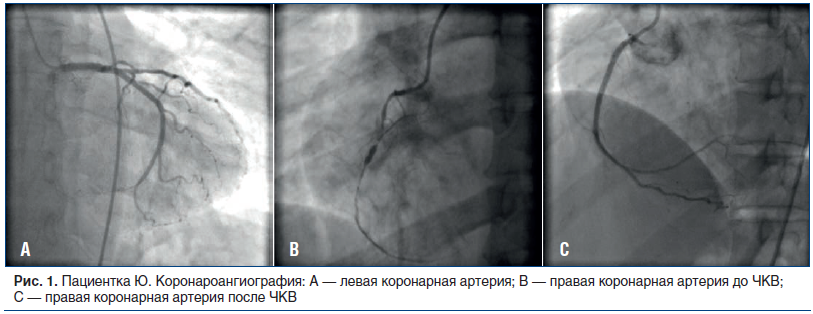
В отделении ангиографических и рентгенооперационных исследований выполнены баллонная ангиопластика и стентирование устья, проксимального и медиального сегментов ПКА (установлено 3 стента с лекарственным покрытием — эверолимусом) с удовлетворительным ангиографическим результатом (рис. 1С).
В раннем послеоперационном периоде пациентка отмечала улучшение самочувствия в виде отсутствия ангинозных болей при физической нагрузке и в покое. При выписке назначено медикаментозное лечение: антиагрегантная и антикоагулянтная терапия (ацетилсалициловая кислота 100 мг/сут; клопидогрел 75 мг/сут), гиполипидемическая терапия (розувастатин 20 мг/сут), антигипертензивная терапия (периндоприл 4 мг/сут), рекомендована гиполипидемическая диета. До второй госпитализации в гинекологическое отделение находилась на амбулаторном наблюдении у кардиолога и гинеколога, отмечала увеличение объема кровопотери при менструации.
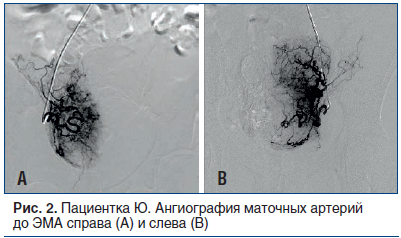
Спустя месяц пациентка поступила на второй этап лечения. Через лучевой доступ проведена ЭМА левой и правой маточных артерий микросферами размером 500–700 µm до стаза контраста в дистальных сегментах артерий (рис. 2 и 3). По результатам послеоперационного ультразвукового исследования (УЗИ) с цветным допплеровским картированием (ЦДК) признаков кровотока в миоматозных узлах не выявлено. Жалобы на момент выписки отсутствовали. Выписана на 5-е сут под амбулаторное наблюдение кардиолога и гинеколога.
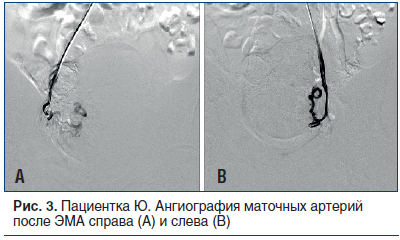
Через 6 мес. проведена контрольная КАГ: ЛКА — без динамики, стенты, установленные в ПКА, проходимы на всем протяжении, без признаков рестеноза. Повторно обследована кардиологом и гинекологом, наблюдалась положительная динамика по обеим патологиям: выявлены повышение толерантности к физической нагрузке (по результатам нагрузочных проб) и регрессия размеров миоматозных узлов с отсутствием признаков кровотока (по результатам УЗИ с ЦДК органов малого таза).
Обсуждение
Выявление у пациентов кардиологического профиля сопутствующих заболеваний, повышающих риск развития геморрагических осложнений, должно быть неотъемлемой частью первичного обследования. В связи с ростом числа женщин, получающих антикоагулянтную и/или дезагрегантную терапию по поводу ССЗ, распространенность аномальных маточных кровотечений увеличивается. Лечение пациенток с ИБС и МТМ должно проводиться совместно кардиологом и гинекологом, с проведением ЧКВ на первом этапе лечения ввиду превалирующего значения ИБС как более жизнеугрожающего заболевания.
Кардиолог должен оценить репродуктивный статус пациентки перед началом ДДТ, гематологические параметры при аномальных маточных кровотечениях, возможность смены ДДТ при возникновении патологических кровотечений, а также своевременно направить к гинекологу для дальнейшего обследования. Гинекологу в свою очередь следует провести оценку менструального анамнеза, выполнить УЗИ с ЦДК органов малого таза, а также избегать назначения гормонального лечения при установленной ИБС, перенесенном инсульте или венозных тромбоэмболических осложнениях [21, 22].
Таким образом, лечение пациенток с сочетанием ССЗ и ММТ требует привлечения различных специалистов (рентгенэндоваскулярных и сосудистых хирургов, гинекологов, кардиологов) для определения наиболее подходящей тактики лечения. Проведение рентгенэндоваскулярного вмешательства позволяет не только объективно подтвердить, но и получить полноценное представление о характере и распространенности патологии. Выбор тактики лечения в пользу ренттгенэндоваскулярной эмболизации привел к адекватному и быстрому устранению патологии с учетом основного заболевания.
В настоящее время не существует клинических рекомендаций по тактике лечения пациенток с сочетанной ИБС и МТМ, а также данных о влиянии ДДТ на возникновение рецидивов кровотечений после проведения ЭМА. Проведение клинических исследований позволит выработать оптимальный междисциплинарный подход к ведению этой категории больных.
Источник