Лечение мастопатии при миоме матки
Содержание статьи
Миома матки и мастопатия: в чем схожесть патологий?
Обновлено: 01 Февраля 2020
Содержание статьи
По мнению специалистов, такие заболевания женской половой сферы, как мастопатия, миома матки тесно связаны между собой. Это обусловлено тем, что развитию обеих патологий предшествуют нарушения в гормональной системе, обусловленные нарушением функции яичников. Заболевание половой системы, как и заболевание в груди связано с увеличением или снижением продукции эстрогена и резким нарушением его баланса в организме женщины.
При данных патологических состояниях на стенках матки и в молочных железах образуются опухоли (узлы и кисты). Все вышесказанное доказывает взаимосвязь миомы с мастопатией, недаром, учитывая схожесть заболеваний, часть специалистов называет миому мастопатией матки.
Мастопатия, как и миома матки, развивается чаще всего у женщин старше 35 лет, особенно у тех, кто перенес хирургические вмешательства с последующим нарушением функционирования яичников.
Мастопатия: основные понятия
Мастопатия является доброкачественным заболеванием молочных желез, в развитии которого немаловажную роль играет гормональный дисбаланс.
Возникновение мастопатии может быть обусловлено снижением или повышением уровня половых гормонов и гормонов щитовидной железы, что характерно для таких патологий, как:
- аднексит;
- патологии щитовидной железы;
- заболевания печени;
- эндокринные патологии;
- сахарный диабет.
Чаще всего мастопатия проявляется постоянными и периодическими болями в молочных железах, особенно перед и во время менструации, уплотнениями в молочных железах. Однако нередко заболевание протекает без характерных симптомов и обнаруживается при плановом осмотре гинеколога.
Мастопатия не представляет опасность для жизни женщины, однако может существенно снижать качество её жизни. Данное заболевание не является предраковым, но его симптомы имеют схожесть с проявлениями рака груди, что необходимо учитывать при диагностике.
Миома матки: основные понятия
Миома матки является гормонально-зависимым, доброкачественным, опухолевидным образованием матки. Может быть одиночной или множественной, различной локализации. Размеры миоматозных узлов могут варьироваться. В зависимости от того, куда направлен рост миоматозного образования, различают следующие разновидности миомы: субсерозную, субмукозную, интерстициальную. Миома крайне редко перерождается в злокачественное образование, однако такие случаи также имеют место.
У женщин с миоматозными узлами небольшого размера заболевание зачастую протекает без характерных симптомов, обнаруживаясь при профилактическом осмотре гинеколога.
По мере роста опухоли присоединяются следующие проявления:
- длительные и обильные менструации (меноррагия);
- наличие сгустков крови в менструальных выделениях;
- ациклические маточные кровотечения (метроррагия);
- анемия.
При миоме, как правило, возникает болевой синдром в пояснице или нижней части живота, в зависимости от размеров и локализации опухоли.
Медленный рост миомы характеризуется постоянными, ноющими болями. При миоматозных узлах субмукозной локализации женщина жалуется на внезапные схваткообразные боли.
Продолжая свое развитие, миоматозное образование может сдавливать близлежащие органы – мочевой пузырь и прямую кишку, вследствие чего нарушаются их функции: затрудняется процесс мочеиспускания, появляются хронические запоры.
Миома большого размера (соответствующая 20 неделям беременности) может провоцировать развитие синдрома сдавления нижней полой вены, для которого характерно повышенное сердцебиение и выраженная одышка (особенно в горизонтальном положении женщины).
Схожесть причин развития миомы матки и мастопатии
Нарушение соотношения половых гормонов в женском организме, неизменно приводящие к гормональным нарушениям, являются одним из основных провоцирующих факторов развития как миомы матки, так и фиброзных разрастаний в молочных железах.
Кроме того, возникновение данных патологий обусловлено следующими причинами:
- эндокринными нарушениями (дисфункцией яичников, надпочечников, гипофиза или щитовидки);
- гнойными хроническими заболеваниями (банальным бронхитом, гайморитом или пневмонией);
- психоэмоциональными нарушениями, связанными со стрессами, психозами, неврозами;
- вредными привычками и неправильным образом жизни, плохой экологической обстановкой и неграмотно подобранной диетой.
Ткань молочных желез является своеобразным фильтром, в котором в большом количестве накапливаются токсины. Вследствие этого не исключен риск развития и роста в ней патологических клеток, которому сопутствует набухание груди, появление в ней болевых ощущений, уплотнение и образование узловых соединений. Именно поэтому огромная роль в профилактике мастопатии принадлежит своевременному лечению инфекционных заболеваний и адекватно подобранной диете.
На слизистой оболочке (эндометрии) матки также отмечается скопление большого количества гнойных токсинов, которые поступают в детородный орган через кровеносную систему из толстого кишечника, в котором находятся каловые массы. Это одна из причин симптоматики при миоме матки, которая появляется постоянными тупыми или тянущими болями в области низа живота, болезненными, достаточно длительными и чрезмерно обильными менструациями.
Кроме того, при опухолях любой локализации (как при мастопатии, так и при миоме) существенно ухудшается общее состояние женщины.
Для обеих данных патологий характерна нервозность женщины, обусловленная постоянными болями и низким уровнем гемоглобина в крови, а также болезненность и набухание молочных желез.
Методы лечения мастопатии и миомы матки
По мнению современных специалистов, устранять необходимо не саму опухоль или болевую симптоматику, а, прежде всего – первопричину, т.е. токсины, вызывающие развитие таких симптомов, что можно сделать с помощью подбора правильной диеты.
Как показывает практика, достаточно часто после удаления узлов в молочных железах у женщины развивается опухоль в матке, и, наоборот, после удаления миомы возникает мастопатия.
Таким образом, удаление опухолей не всегда приводит к полному выздоровлению, потому большинство специалистов для избавления от данных патологий рекомендуют проведение комплексного лечения, устраняющее причины недуга и уменьшающее его проявления.
В качестве методов лечения применяется гормональная терапия, эндоваскулярные методы, а также ЭМА (для лечения миомы матки). ЭМА (эмболизация маточных артерий) является современным методом лечения миомы, несмотря на свой относительно молодой возраст, успевшим завоевать признание как специалистов, так и пациенток. С помощью данного органосохраняющего и малоинвазивного метода удается навсегда избавиться от миоматозных узлов — рецидивы после ЭМА отсутствуют. ЭМА проводится в ведущих медицинских центрах, оснащенных необходимым высокотехнологичным оборудованием, со списком можно ознакомитьсяздесь.
Узнать подробную информацию о методе ЭМА, нюансах подготовки к процедуре и записаться на консультацию к специалисту можно по телефону.
Эффективность лечения во многом зависит от самой женщины. Рекомендуется отказаться от вредных привычек, очистить организм от вредных токсинов, нормализовать питание, не пренебрегать дополнительными методами лечения: физиотерапией, фитотерапией, гирудотерапией и т.д.
Любое заболевание поддается терапии гораздо легче, если оно обнаруживается на ранних стадиях развития. Поэтому минимум один раз в год женщина, особенно старше 40 лет, должна проходить профилактический осмотр и диагностическое обследование у гинеколога.
Список литературы:
- Савицкий Г. А., Иванова Р. Д., Свечникова Ф. А. Роль локальной гипергормонемии в патогенезе темпа прироста массы опухолевых узлов при миоме матки //Акушерство и гинекология. – 1983. – Т. 4. – С. 13-16.
- Сидорова И.С. Миома матки (современные аспекты этиологии, патогенеза, классификации и профилактики). В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2003; 5—66.
- Мериакри А.В. Эпидемиология и патогенез миомы матки. Сиб мед журн 1998; 2: 8—13.
- Бобров Б.Ю. Эмболизация маточных артерий в лечении миомы матки. Современное состояние вопроса // Журнал акушерства и женских болезней. 2010. №2. С. 100-125
- Б. Ю. Бобров, С. А. Капранов, В. Г. Бреусенко и др. Эмболизация маточных артерий: современный взгляд на проблему. «Диагностическая и интервенционная радиология» том 1 № 2 / 2007
Эндоваскулярный хирург, кандидат медицинских наук, самый большой персональный опыт ЭМА в России
Гинеколог, кандидат медицинских наук
Акушер-гинеколог, онколог, кандидат медицинских наук
Врач акушер-гинеколог
Источник
Купирование мастодинии при гормональном лечении пациенток с миомой матки
Высокая частота (до 54,2%) сочетания миомы матки и доброкачественных дисплазий молочных желез (ДДМЖ) может быть обусловлена их собственной широкой распространенностью и определенной общностью этиологии и патогенеза (рис. 1, 2).
Несмотря на то, что история лечения миомы матки и мастопатии насчитывает более века, на сегодняшний день так и не выработано единой точки зрения на методы терапии этих заболеваний. До сих пор не создана единая модель патогенетической терапии, которая помогла бы практическому врачу в выборе рациональных медикаментозных комплексов. Остается нерешенным вопрос адекватной продолжительности терапии. Несомненно, лечение должно быть комплексным, длительным, учитывать гормональные и метаболические особенности пациентки, а также сопутствующую патологию.
Положительный терапевтический эффект применения традиционных методов лечения диффузной мастопатии (йодистый калий, бромкамфара, комплекс витаминов А, В1, В6, С, препараты андрогенового ряда) не превышает 47–54%. Использование в комплексной терапии синтетических прогестинов позволяет повысить терапевтический эффект до 78–83% [13, 14, 22, 23], но может способствовать прогрессированию метаболических нарушений. Применение препаратов боди-идентичного прогестерона при лечении мастопатии у больных с миомой матки способно провоцировать быстрый рост последней.
Развитие современных технологий в фармакологии увеличивает арсенал средств (антиэстрогены, ингибиторы ароматазы, агонисты Гн-РГ, антагонисты гонадолиберинов, селективные тканевые модуляторы рецепторов эстрогенов, селективные модуляторы рецепторов прогестерона) и методов лечения сочетанных доброкачественных пролиферативных заболеваний женской половой сферы. На современном этапе клинический поиск требует создания максимально эффективных поликомпонентных схем лечения, в которых необходимо учитывать противопоказания к назначению лекарственных препаратов и обеспечивать максимальную безопасность и комфортность лечебного процесса для пациентки. Многие синтетические препараты не нашли широкого применения из-за побочных эффектов или противопоказаний при сочетанных патологиях. Поэтому разработка негормональных, но эффективных лекарственных средств также остается актуальной.
Достаточно большое количество литературных данных, основанных на клинических исследованиях, свидетельствуют об эффективном применении при лечении мастопатии растительных и гомеопатических препаратов [1, 3, 4, 7, 16–19], что особенно важно при их назначении у больных с миомой матки.
По данным литературы [6, 10], эффективность фито- и гомеопатических препаратов в различных вариантах клинического течения некоторых сочетанных нозологий может достигать 40–87%. Среди многочисленных лекарственных растений, обладающих тропностью к нейроэндокринной системе человека и животных, наиболее изученным в последнее десятилетие является Agnus castus (AС). Vitex agnus castus (прутняк, монаший перец, авраамово дерево) принадлежит к семейству вербеновых (Verbenaceae) [8, 9, 11, 12, 20, 21]. Природный ареал произрастания – Средиземноморье, Крым, Африка, наиболее теплые регионы Азии и Америки.
Для лечебных целей используются плоды AС, содержащие иридоиды, флавоноиды и эфирные масла. В последнее время после изучения фармакологических свойств экстрактов АC стало возможным их широкое применение [24, 26, 27] (в экспериментах in vitro показано, что экстракты АС обладают высоким сродством к D2-эндорфинным рецепторам) [25, 26, 28, 29–31, 33–36]. У пяти выделенных из бициклических дитерпенов веществ определены допаминергическая активность и селективное сродство к эстрогеновым рецепторам. Эффект компонентов, имеющих химическую структуру дитерпенов, заключается в дозозависимом торможении образования цАМФ лактотрофами передней доли гипофиза и благодаря этому – в ингибировании синтеза пролактина [2, 15] .
В настоящее время в РФ имеется целый ряд фитопрепаратов, содержащих Vitex agnus castus. В их ряду заслуженное место занимают Циклодинон и Мастодинон (Бионорика СЕ). В литературных источниках представлено достаточное количество детальных исследований действия препаратов на основе Vitex agnus castus: эффективное использование для лечения латентной гиперпролактинемии (ГП) и мастодинии, предменструального и климактерического синдромов [39, 42–46] .
Мастодинон – комплексный растительный лекарственный препарат, в состав которого, помимо витекса священного, входят в гомеопатических разведениях экстракты фиалки альпийской, касатика разноцветного, стеблелиста василистниковидного, лилии тигровой, а также чилибуха игнация.
По данным исследований, основным клиническим проявлением лечебного воздействия этих ингредиентов является прежде всего устранение болей в молочных железах, а также лечение предменструального синдрома, диффузной фиброзно-кистозной мастопатии и нарушений менструального цикла. В литературе описывается большая эффективность применения препарата Мастодинон по сравнению с известными растительными аналогами. Широкое применение Vitex agnus castus нашел в лечении многих гинекологических заболеваний: расстройств менструального цикла, аменореи, недостаточности лютеиновой фазы, предменструального синдрома. Основным механизмом действия препарата Мастодинон является стимулирующее воздействие содержащихся в нем биологически активных веществ – дитерпенов – на дофаминовые D2-рецепторы передней доли гипофиза, что приводит к снижению секреции пролактина и регрессу патологических процессов в молочных железах, купированию циклического болевого синдрома при мастопатии и предменструальном синдроме. В ходе экспериментальных исследований, в т. ч. двойного слепого плацебо-контролируемого исследования [11], было установлено, что бициклические дитерпены, выделенные из Agnus Castus BNO 1095, могут вызвать уменьшение секреции пролактина лактотропными клетками за счет связывания с D2-рецепторами гипофиза и сокращения в результате этого продукции циклического аденозинмонофосфата и повышения выработки допамина. Пролактин играет доминантную роль в патогенезе ежемесячно возникающей предменструальной масталгии. Эффективность Мастодинона в уменьшении болевого синдрома в молочных железах доказана в целом ряде клинических, в т. ч. рандомизированных плацебо-контролируемых исследований. По данным W. Wuttke (1997), M. Halaska (1999), более чем у 70% пациенток масталгия купировалась в течение 3 мес. лечения Мастодиноном [3, 5, 8, 37, 38, 40, 41]. Таким образом, поскольку Мастодинон способствует уменьшению болей при мастопатии и предменструальном синдроме, а также уменьшает отек железистого компонента, он может рекомендоваться для лечения диффузной формы ДДМЖ. Наличие комплекса патогенетически обоснованных механизмов действия у препарата Мастодинон позволяет использовать его с целью «прикрытия» молочной железы от нежелательных эффектов при назначении гормональных препаратов: комбинированных оральных контрацептивов, заместительной гормональной терапии и препаратов для стимуляции овуляции или суперовуляции в рамках вспомогательных репродуктивных технологий. Это оказалось важным и при использовании нового препарата для лечения больных миомой матки – селективного тканеспецифичного антагониста-агониста рецепторов прогестерона Улипристала ацетата (УА). Проведенные нами клинико-морфологические исследования свидетельствуют о том, что молекулярно-биологические механизмы подавления роста и уменьшения размеров ЛМ под влиянием УА заключаются в селективном влиянии УА на миому матки:
• снижение процессов пролиферации и гипертрофии;
• индуцирование апоптоза;
• уменьшение митотической активности;
• снижение экспрессии сосудистого эндотелиального фактора роста;
• склероз и гиалиноз ЛМ.
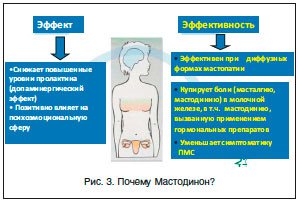
Рекомендованной пероральной дозой УА при лечении больных миомой матки является 1 таблетка (5 мг) 1 р./сут. Лечение следует начинать в первую неделю менструального цикла и продолжать 3 мес. Пациентки должны быть проинформированы, что лечение УА приводит к заметному уменьшению менометроррагий уже в течение первых 10 дней терапии и вызывает аменорею. Возобновление нормальных менструаций происходит, как правило, в течение 4-х нед. после завершения курса терапии, если пациентка до этого времени не прооперирована. В настоящее время УА в дозе 5 мг/сут зарегистрирован в РФ для предоперационного лечения умеренных и выраженных геморрагических и компрессионных симптомов у больных миомой матки. Однако уже вносятся изменения в инструкцию о возможности повторных курсов терапии УА при положительной клинической динамике. При дальнейшем изучении свойств этого препарата, дифференцированном подходе к выбору метода лечения он сможет занять и самостоятельную нишу в лечении ряда больных миомой матки. Однако при его использовании нами зарегистрированы два основных нежелательных эффекта: мастодиния и агрессивность. Мы успешно купировали их назначением Мастодинона 2 р./сут (рис. 3).
Основными клиническими проявлениями лечебного воздействия Мастодинона в комбинированном лечении являются устранение болей в молочных железах и улучшение психического статуса, заключающееся в улучшении функционального состояния вегетативной нервной системы, позитивном влиянии на психоэмоциональную сферу. Таким образом, при проведении современных гормональных курсов терапии у больных с миомой матки возможно использование лекарственного препарата Мастодинон с целью обеспечения максимальной безопасности и комфортности лечебного процесса для пациентки.

Литература
1. Бурдина Л.М., Бурдина И.И. Мастодинон Н и его роль в лечении доброкачественных заболеваний молочных желез// Маммология. 1998. № 4. С. 28–34, С. 45–57.
2. Вознюк Н.Е., Старикова Л.Г., Хоружая В.А. Пролактиномы и гиперпролактинемия // Вестн. новых мед. техн. 2000. Т.VII, № 2. С. 97–100.
3. Гуркин Ю.А. Современный взгляд на лечение девочек и девушек, страдающих патологией молочных желез // Журнал акушерства и женских болезней (Санкт-Петербург). 2000. Т. XLIX, вып. 3.
4. Горячева Л.А., Пинхосевич Е.Г. Фитотерапия при заболеваниях молочных желез. .М., 96.
5. Дедов И.И., Семичева Т.В., Петеркова В.А. Половое развитие детей: норма и патология.
М.: «Колор Ит Студио», 2002. С. 1–232.
6. Канцалиев А.Л. Эффективность препаратов мастодинон Н и веторон в схемах лечения дисгормональной патологии молочных желез // Маммология, 1998. № 4. С. 35–39.
7. Левенець С.О., Верхошанова О.Г., Перевозчиков В.В. Рівень пролактину та його корекція у дівчат із передчасним телархе // Здоровье женщины. 2007. №1 (29). С. 134–139.
8. Мустафин Ч.Н.Диагностика и лечение диффузных мастопатий // Маммология. 2009. С. 20–23.
9. Наумкина Н.Г. Новые подходы к диагностике и лечению фиброзно-кистозной болезни молочной железы: автореф. канд. дисс. М., 1999. С. 3–15.
10. Пинхосевич Е.Г., Бурдина Л.М., Горячева Л.А. и др. Фитотерапия при заболеваниях молочных желез и клинико-рентгенологическая оценка результатов лечения // Маммология. 1996. № 4. С.15–21.
11. Прилепская В.Н., Тагиева Т.Т. Фиброзно-кистозная болезнь молочных желез: возможности негормональной терапии. М.: Медлайн-Экспресс, 2008. № 5. С. 10–17.
12. Рожкова Н.И., Меских Е.В. Оценка эффективности фитотерапии мастодиноном и гелариумом у больных с диффузными формами мастопатии // Опухоли женской репродуктивной системы. 2008. № 4. С. 1–2.
13. Семиглазова В.Ф. Мастопатия. СПб.: Карэ, 2000. 109 с.
14. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. Гинекологическая эндокринология. М.: МЕДпресс-информ, 2004. 528 с.
15. Cavaco B., Leite V., Santos M.A. et al. Some forms of big big prolactin behave as a complex of monomeric prolactin with an immunoglobulin G in patients with macroprolactinemia or prolactinoma // J. Clin. Endocrinol. b.1995. Vol. 80. P. 2342–2346.
16. Cardiff R.D., Wellings S.R. The comparative patology of human and mouse mammary glands // J. Mammary Gland Biol. Neoplasia. 1999. Vol. 4. P.105–122, 123.
17. Gruber C.J., Walter Tschugguel, Schneeberger C., Johannes C. Huber. Production and Action of Estrogens // New Engl. J. Med. 2002. Vol. 346. № 5. Р. 340–352,145.
18. Kaplowitz P.B., Oberfield S.E. Reexamination of the age limit for defining when puberty is precocious in girls in the United es: implications for evaluation and treatment. Drug and Therapeutics and Executive Committees of the Lawson Wilkins Pediatric Endocrine Society // Pediatrics. 1999. Vol.104(4 Pt 1). P. 936–941.
19. Pediatric Endocrinology and Growth J.K.H. Wales et al. 2nd edition, 2003. P. 41–85.
20. Halaska M., Beles P., Gorkow C., Sieder C. Treatment of cyclical maslalgia with a solution containing an ct of Vitex agnus castus: Recent results of a placebo–controlled double-blind study // The Breast. 1999. Vol. 8. P. 175–181.
21. Wuttke W., Splitt G., Gorkow C., Sieder C. Behandlung zyklusabhangiger Brustschmerzen mit einem Agnus castus-haltigen Arzneimittel. Ergebnisse einer randomisierten, placebokontrollierten Doppelblindstudie // GebFra. 1997. Vol. 57. P. 569–574.
22. AACE Menopause Guidelines Revision Task Force. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the diagnosis and treatment of menopause // Endocr. Pract. 2006. Vol. 12. P. 315–337.
23. Ghent W.R., Eskin B.A., Low D.A., Hill L.P. Iodine replacement in fibrocystic disease of the breast // Can. J. Surg. 1993. Vol. 36. P. 453–460; Kaunitz A.M. Oral contraceptive health benefits: perception versus reality // Contraception. 1999. Vol.59 (Suppl.1). P. 29–33; Schweppe K.W. The ificance ofgestagens in treatment ofmastopathy // Zentralbl. Gynakol. — 1997. Vol.119 (Suppl. 2). P.5 4–89, 58; von Fallois J., Etterli-Billenkamp U., Schindler E.M., Schindler A.E. Danazol for treatment of fibrocystic mastopathy // Zentralbl. Gynakol. 1995. Vol.117. P. 457–465.
24. Brickell C.(ed). London: Dorling Kindersley, 1989.
25. Brugisser R., Burkard W., Simmen U., Schaffner W. // Phytotherapie. 1999. Vol. 20:3. P.154–158.
26. Christoffel V., Spengler B., Abel G. et al. Proceedings of the 6th Annual Symposium on complementary // Health Care. UK. Vol. 199.
27. Du Mee V.A.C. // Aust. J. Med. Herbalism. 1993. Vol. 5. P. 63–65.
28. Jarry H., Christoffel V., Spengler B. et al. Phytotherapie (Munchen), 1999.
29. Hoberg E. Swiss Federal Institute of Technology. Zurich, 1999.
30. Kilicdag E.B., Tarim E., Bagis T. et al. // Int. J. Gyn. Obstet. 2004. Vol. 85. P. 292–293.
31. Merz P.G., Gorkow C., Schrodter A. et al. // Exp. Clin. Endocr. Diabet. 1996. Vol. 104:6. P. 447–453.
32. Pravidel. Novartis Pfarma GmbH Germany, 2004.
33. Wuttke W., Gorkow Ch., Jarry H. Darmstadt: Steinkopff Verlag, 1995. P. 81–91.
34. Sliulz G., Speiser P., Schultz A.M. et al. Agnus-castus cts inhibit prolactin secretion of rat pituitary cells // Horm. bol. Res. 1993. Vol. 25. P. 243–255.
35. Spengler В., Schmidt J., Porzel A., Christoffel V. Isolation and characterization of cyclic diterpenes from BNO 1095 (Vitex agnus castus). In preparation, 1999.
36. Wuttke W., Gorkow C., Jarry H. Dopaminergic compounds in Vitex agnus castus // Loew D., Rietbrock N. (Hrsg). Phytopharmaka in forschung und klinischer Anwendung. Darmstadt: Steinkopff, 1995. P. 81–91.
37. Atmaca M. Kumru, Tezcan S.E. Fluoxetine Versus Vitex agnus kastus kt in the treatment of premenstrual dysorder // Hum. Psychopharmacol. 2003. Vol. 18:3. P. 191–195.
38. Breckwoldt M. Endocrinology and Therapy of breast diseas // Zentral BL. Gynakol. 1990. Vol. 112. P.1097–1099.
39. Berger D. Vitex agnus kastus: Unbeden Klichkeit and Wirksamkeit beim praemenstruallen Syndrom, Wirkprinzipien und Wirkmechanismen eines neuetwickelten ktes: Dissertation, Phit-Naturwissenserliebe Fakultat.Besel, 1998. P.220
40. Castillo E., Garibay M., Mirabent F. Effect of alfa dihydroergocriptine in patients with fibrocistiс breast disease // Gynecol. Obstet. Mex. 2006. Vol. 74. P. 580–584.
41. Daniele C., Thompson Coon J. Piuler M.H., Ernst E. Vitex agnus kastus a systematic review of adverse events // Drug. Saf. 2005. Vol. 28. P. 319–332.
42. Hoberg E., Sticher O., Orjala J.E., Meier B. Diterpene aus Fgni-casti fructus und ihre Analytik // Ztsehr. Phytother. 1999. Vol. 149. P. 3.
43. Jarr H., Leonardt S., Wunke W. Agnus kastus als dopaminerges. Wirkprinzip in Mastodynon // N. Ztsehr. Phytother. 1991. Vol. 12. P. 77–82.
44. Sliutz G., Speiser P., Schultz A.M. Agnus kastus ks ingibit prolactin secrecion of pituitery cell // Horm. bol. Res. 1993. Vol. 25. P. 243–255.
45. Spengler B., Schmidt J., Porcel A. Ilolation and characterization of cyclic diterpenes from BNO 1095 (Vitex agnus kastus). In preparation, 1999.
46. Wunke W., Gorcow C., Jarry H. Dopaminergie compounds in Vitex agnus kastus // Loew D., Rietbrock N. (Hrsg). Phytopharmaka in forschung und klinischer Anwendung. Darmstadt: Steinkopf, 1995. P. 81–91.
Источник